TEMA 5 : PROTEÍNAS
¡Hola a todos! , hoy vengo a traeros una entrada sobre otra biomolécula orgánica , en este caso las proteínas , una de las macromoléculas más importantes.
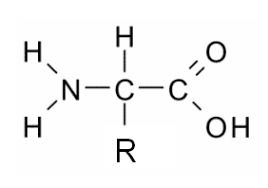
En primer lugar es importante saber que las proteínas se forman a partir de unos compuestos orgánicos sencillos de bajo peso molecular , los aminoácidos , estos están formados por un átomo de H , un grupo amino -NH2 , un grupo carboxilo -COOH y un grupo radical , que es en lo que se van a diferenciar unos de otros , todos ellos unidos a un carbono alfa (asimétrico) . De todos los aminoácidos solo 20 se van a usar para formar proteínas , 12 de ellos los fabrica nuestro organismo , los 8 restantes se denominan , aminoácidos esenciale sy deben ser ingeridos a través de la dieta.
Esta es su estructura :
FUENTE IMAGÉN : GOOGLE DERECHOS LIBRES ( ETIQUETADA PARA REUTILIZACIÓN )
PROPIEDADES AMINOÁCIDOS :
- Carácter anfótero : en disolución acuosa se comportan como ácido o como base captando o cediendo protones , para regular el pH.
- Elevado punto de fusión
- Dos configuraciones espaciales : D y L ( aminoácidos proteicos aparecen como L )
- Actividad óptica
Estos aminoácidos se unen por ...ENLACES PEPTÍDICOS ( entre un grupo -COOH de un aminoácido y un grupo -NH2 de otro aminoácido, perdiéndose una molécula de H2O) , este enlace es rígido lo que le impide girar libremente.

FUENTE IMAGÉN : GOOGLE DERECHOS LIBRES ( ETIQUETADA PARA REUTILIZACIÓN )
Las proteínas pueden tener hasta 4 niveles de organización ( ESTRUCTURA )
 FUENTE IMAGÉN : GOOGLE DERECHOS LIBRES ( ETIQUETADA PARA REUTILIZACIÓN )
FUENTE IMAGÉN : GOOGLE DERECHOS LIBRES ( ETIQUETADA PARA REUTILIZACIÓN )
- ESTRUCTURA PRIMARIA : secuencia lineal de aminoácidos que componen la proteína , disposición en zigzag
- Enlaces : peptídicos entre aminoácidos y covalentes entre los grupos unidos al carbono alfa de un aminoácido.
- ESTRUCTURA SECUNDARIA: disposición espacial adoptada por la estructura primaria para poder ser más estable
- ALFA HÉLICE : cadena con estructura primaria se enrolla en espiral sobre sí misma
- Enlaces : enlaces de H intracatenarios , también tiene los enlaces covalentes y peptídicos ya comentados
- CONFORMACIÓN BETA : conservan estructura en zigzag , y se asocían entre sí ( Enlaces de H intercatenarios )
- Enlaces : enlaces de H intercatenarios , peptídico y covalentes ( en el aminoácido y entre aminoácidos )
- Enlaces : enlaces de H intercatenarios , peptídico y covalentes ( en el aminoácido y entre aminoácidos )
- HÉLICE DE COLÁGENO : estructura rígida compuesta por prolina e hidroxiprolina ( más larga que alfa hélice ) -> propia del colágeno
- Enlaces : estas hélices se unen por enlaces covalentes y enlaces de H , dentro de la propia hélice presenta los mismos que la alfa hélice
- ALFA HÉLICE : cadena con estructura primaria se enrolla en espiral sobre sí misma
- ESTRUCUTRA TERCIARIA : disposición espacial adoptada por la estructura secundaria cuando se pliega sobre sí misma , las características y funciones de las proteínas dependen de esta estructura .
- Enlaces : puentes de H , atracciones electroestáticas e hidrofóbicas , fuerzas de Van der Waals y puentes disulfuro .
- Según esta estructura encontramos dos tipos de proteínas :
- Globulares :
- cadenas peptídicas se enrollan dando lugar a moléculas casi esféricas
- solubles en agua
- funciones activas
- ejemplo : mioglobina
- Fibrosas o Filamentosas:
- moléculas alargadas
- insolubles
- funciones estructurales
- ejemplo : colágeno
- Globulares :
- ESTRUCTURA CUATERNARIA: proteínas formadas por dos o más cadenas polipeptídicas ( PROTÓMEROS )
- Enlaces : se unen por enlaces débiles no covalentes y por enlaces disulfuro
CLASIFICACIÓN:
- HOLOPROTEÍNAS : formadas por aminoácidos
- Fibrosas o filamentosas
- Globulares
- HETEROPROTEÍNAS : amonoácido + grupo prostético
- Cromoproteínas
- Porfínicas ( hemoglobina )
- No porfínicas ( hemocianina )
- Nucleoproteínas ( histonas )
- Glucoproteínas ( inmunoglobulinas )
- Fosfoproteínas ( caseína )
- Lipoproteínas ( colesterol )
- Cromoproteínas
PROPIEDADES :
- Solubilidad : radicales polares en contacto con el agua , rodeados de una capa de agua , por tanto precipita al no poder unirse
- Desnaturalización : rotura de enlaces y perdida de las estructuras secundaria , terciaria , y cuaternaria debido a factores como la temperatura , pH , polaridad del disolvente o sustancias desnaturalizantes como la urea .Esta puede ser reversible si no ha afectado a los enlaces peptídicos
- Especificidad : de función , dependiendo de la posición que ocupan en la secuencia lineal y de especie e incluso de cada individuo . Las proteínas que realizan la misma función en distintas especies , se denominan proteínas homólogas ( tienen aminoácidos parecidos , no se altera el centro activo )
- Capacidad amortiguadora : debido a su carácter anfótero , ya comentado anteriormente
FUNCIONES :
1. Reserva ( ovoalbúmina )
2. Función de transporte ( hemoglobina )
3. Función contráctil ( actina y miosina )
4. Función protectora o defensiva ( inmunoglobulinas )
5. Transducción de señales ( rodopsina )
6. Función hormonal ( insulina )
7. Función estructural ( colágeno )
8. Función enzimática ( hidrolasa )
9. Función homeostática. ( trombina )
10. Función de reconocimiento de señales químicas ( anticuerpos )
* Lo que se indica entre paréntesis es un ejemplo de cada función , pero hay más ejemplos de cada una de ellas*
Aquí os adjunto el esquema del tema :
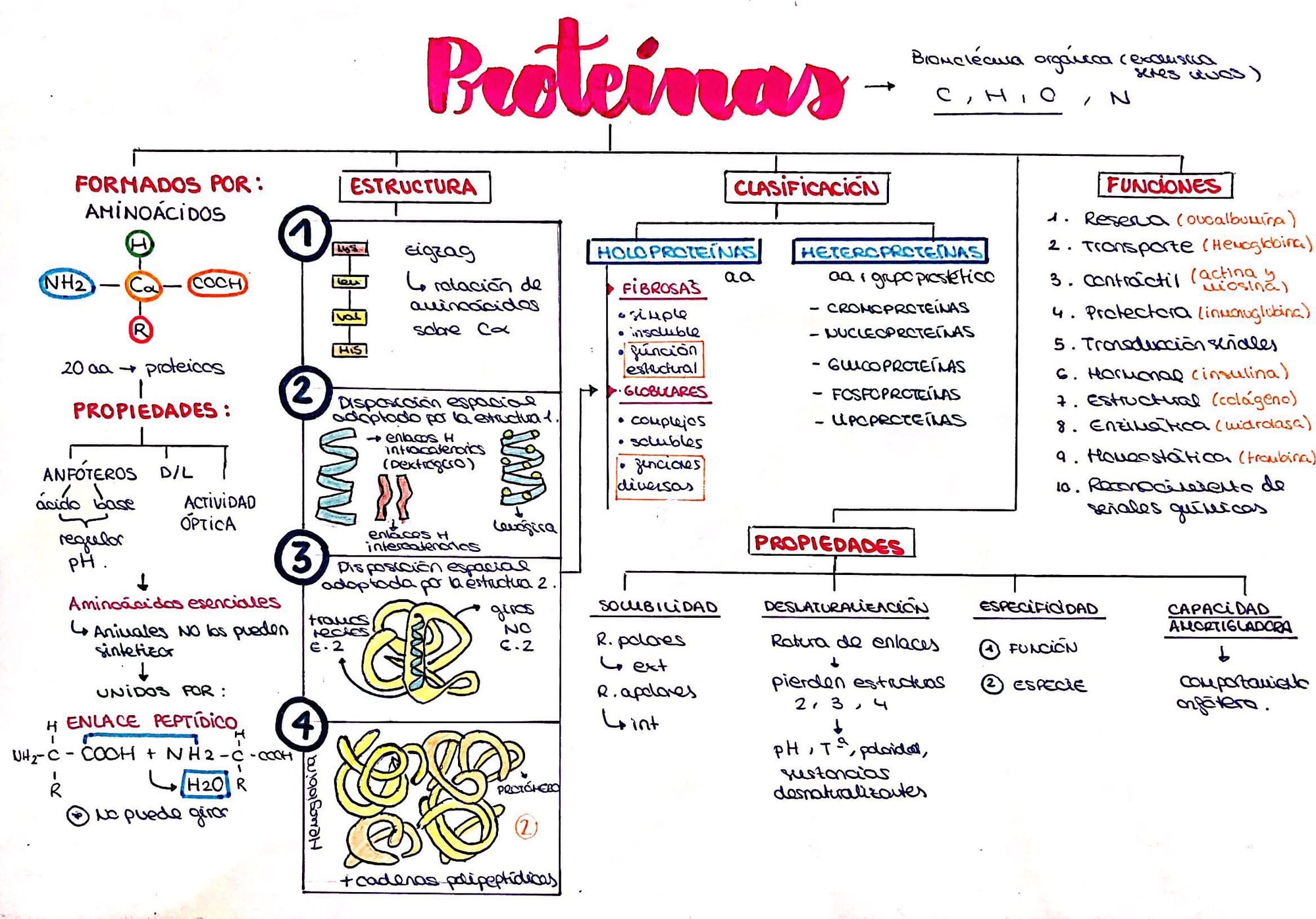
new doc 2018-11-05 21.58.42_20181105215919805.pdf ( aquí os adjunto el enlace para poder observar con mejor calidad el esquema )
FUENTE INFORMACIÓN : APUNTES DEL COLEGIO VIRTUAL Y DE CLASE
ACTIVIDADES DE PROTEÍNAS
1.CON RESPECTO A LAS PROTEÍNAS
a) ENUMERAR LOS CUATRO NIVELES DE ESTRUCTURAS DE LAS PROTEÍNAS
Las proteínas se presentan en el espacio formando una estructura tridimensional definida , que puede tener hasta cuatro niveles de organización ; estructura primaria , estructura secundaria , estructura terciaria y estructura cuaternaria .
b) INDICAR QUÉ TIPOS DE ENLACES INTERVIENEN EN LA ESTABILIZACIÓN DE CADA UNO DE ESTOS NIVELES ESTRUCTURALES
En la estrucutra primaria , se dispone en forma de zigzag debido a la planaridad del enlace peptídico , lo que produce la rotación de aminoácidos sobre el carbono alfa .
En la estructura secundaria , en la alfa hélice intervienen enlaces de hidrógeno intracatenarios , entre un grupo -NH de un enlace peptídico y un grupo -CO del cuarto aminoácido que lo sigue , al igual que los enlaces covalentes y peptídicos entre aminoácidos y dentro del mismo . En el caso de la conformación beta , los enlaces de hidrógeno son intercatenarios , y en el enlace participan todos los aminoácidos peptídicos dando estabilidad a la molécula así como los enlaces covalentes y peptídicos entre aminoácidos y dentro del mismo. En la hélice de colágeno , las hélices se unen mediante enlaces covalentes y enlaces débiles de tipo enlace de hidrógeno , formándo así el colágeno una proteína muy estable .
En la estructura terciaria , se mantiene estable gracias a las uniones entre los radicales de aminoácidos que están muy separados entre sí . Estas uniones pueden ser ; enlaces de hidrógeno , atracciones electroestáticas , fuerzas de Van der Waals , atracciones hidrofíbicas y puentes disulfuro .
En la estructura cuaternaria , las cadenas polipeptídicas con estructura terciaria se unen entre sí por enlaces débiles ( no covalentes ) y enlaces covalentes del tipo disulfuro .
c) ESPECIFICAR LA ESTRUCUTRA QUE CARACTERIZA LAS α-QUERATINA
La estructura correspondiente a la alfa queratina , es la estrucutra secundaria , que es la disposición espacial adoptada por la estructura primaria para poder ser estable .
En la alfa queratina , la cadena proteica con estructura primaria , se enrolla en forma de hélice sobre si misma debido a los giros que se producen entorno al carbono alfa de cada aminoácido . Se mantiene estable gracias a los enlaces de hidrógeno intracatenarios , entre un grupo -NH de un enlace peptídico y un grupo -CO del cuarto aminoácido que lo sigue . La rotación es dextrógira , ya que gira hacia la derecha y tiene 3,6 aminoácidos por vuelta . Los grupos -NH se sitúan hacia el mismo lado y los -CO hacia el lado contrario , mientras que los radicales quedan en el exterior de la estructura alfa hélice .
d) DESCRIBIR DOS PROPIEDADES GENERALES DE LAS PROTEÍNAS
Una de ellas es la solubilidad , los radicales polares se sitúan en la superficie externa y establecen enlaces de hidrógeno con el agua , formando una capa de agua que impide su unión con otras proteínas y por tanto su precipitación . En general los proteínas fibrosas son insolubles en agua .
Otra propiedad importante de las proteínas es la especificidad , por una lado especificad de función ya que depende de la posición de los aminoácidos que constituyen la secuencia lineal , una pequeña variación en la secuencia puede suponer la perdida de la función de la proteína . Por otro lado ,la especificidad de especie , existen proteínas exclusivas para cada especie e incluso cada individuo , ya que dependen de la información genética . Las proteínas que desempeñan la misma función en distintas especies suelen tener una composición y estructuras similares y se denominan proteínas homólogas .
e) DESCRIBIR DOS FUNCIONES DE LAS PROTEÍNAS . INDICA EJEMPLO
Función de reserva , los aminoácidos se almacenan para utilizarlos como nutrientes o para colaborar en la formación del embrión , por ejemplo la ovoalbúmina ( clara de huevo ) o la caseína ( leche )
Otra función que desempeñan las proteínas , es función enzimática , ya que las enzimas son catalizadores bioquímicos que aumentan la velocidad de reacciones bioquímicas , como por ejemplo ; hidrolasas , polimerasas …
f) DEFINA EL PROCESO DE DESNATURALIZACIÓN . ¿ QUÉ TIPO DE ENLACES NO SE VEN AFECTADOS ?
La desnaturalización es la rotura de los enlaces , que mantienen el estado nativo de la proteína , que es el estado más estable de una proteína plegada y tiene la menor energía libre a partir de los enlaces no covalentes entre los aminoácidos y cualquier grupo prostético .Los enlaces que no se ven afectados son los enlaces peptídicos que mantienen la estructura primaria .
En este proceso se pierden el resto de estructuras y con ello su actividad biológica . La proteína desnaturalizada suele precipitar , ya que los grupos hidrofóbicos salen al exterior y se agrupan . Esta desnaturalización puede ser provocada por varios factores como el pH , la temperatura , la polaridad del disolvente o sustancias desnaturalizantes como la urea .Esta desnaturalización puede ser reversible , produciéndose una renaturalización , las proteínas pueden replegarse y adoptan de nuevo su conformación nativa , recuperando su actividad biólogoica .
g) ¿QUÉ SIGNIFICA QUE UN AMINOÁCIDO ES ANFÓTERO ?
Un aminoácido es anfótero , ya que en disolución acuosa , los aminoácidos son capaces de ionizarse y comportarse como ácido ,cediendo protones al medio ( cuando el medio es básico ), o como base captando protones del medio ( cuando el medio es ácido ) , permitiendo así regular el pH .
ACTIVIDADES PAU
1.EN LA SIGUIENTE REACCIÓN DOS MONÓMEROS REACCIONAN PARA FORMAR UN DÍMERO :
A) ¿ QUÉ MOLÉCULAS SON ESTOS MONÓMEROS ? ¿ EN QUÉ TIPO DE MACROMOLÉCULAS SE ENCUENTRA ESTA UNIÓN ?
Las moléculas de la imagen son aminoácidos , la unión formado entre los dos aminoácidos es un enlace peptídico y es característico de las proteínas.
B) ¿ CÓMO SE DENOMINA EL ENLACE QUE SE FORMA ENTRE ESTOS MONÓMEROS ?¿ CUÁLES SON LAS CARACTERÍSTICAS DE ESTE ENLACE ?
El enlace entre los dos aminoácidos se denomina enlace peptídico . Este enlace es un enlace covalente , que se forma entre un grupo carboxilo de un aminoácido y un grupo amino del siguiente aminoácido , con la perdida de una molécula de agua . Los grupos amino y carboxilo que quedan libres en los extremos de los péptidos se llaman N - terminal y C - terminal respectivamente . Este enlace es un enlace covalente más corto que la mayor parte de los enlaces C y N . Además , posee cierto carácter de doble enlace , lo que le impide girar libremente . Los cuatro átomos que forman parte de este enlace peptídico junto con los dos átomos de carbono a los que se unen , se encuentran en un plano .
C) CITA DOS EJEMPLOS DE ESTA MACROMOLÉCULA E INDICA SU FUNCIÓN .
Hemoglobina : tiene función de transporte , es un pigmento de color rojo presente en la sangre de vertebrados , transporta oxígeno desde el aparato respiratorio hasta las células
Insulina : tiene función hormonal , es secretada por el páncreas cuando las concentraciones de glucosa en sangre son elevadas .Retira la glucosa del torrente sanguíneo y la transporta a las células , donde será metabolizada durante la glucolísis.
2.EXPLICA EL TIPO DE INTERACCIONES O ENLACES QUE ESTABILIZAN LA ESTRUCTURA SECUNDARIA Y TERCIARIA EN PROTEÍNAS
Dentro de la estructura secundaria , en la alfa hélice intervienen enlaces de hidrógeno intracatenarios , entre un grupo -NH de un enlace peptídico y un grupo -CO del cuarto aminoácido que lo sigue al igual que los enlaces covalentes y peptídicos entre aminoácidos y dentro del mismo . En el caso de la conformación beta , los enlaces de hidrógeno son intercatenarios , y en el enlace participan todos los aminoácidos peptídicos dando estabilidad a la molécula, también participan los enlaces covalentes y peptídicos entre aminoácidos y dentro del mismo. En la hélice de colágeno , las hélices se unen mediante enlaces covalentes y enlaces débiles de tipo enlace de hidrógeno , formándo así el colágeno una proteína muy estable .
En el caso de la estructura terciaria , se mantiene estable gracias a las uniones entre los radicales de aminoácidos que están muy separados entre sí . Estas uniones pueden ser ; enlaces de hidrógeno , atracciones electroestáticas , fuerzas de Van der Waals , atracciones hidrofíbicas y puentes disulfuro .
3.¿QUÉ SIGNIFICA QUE LOS AMINOÁCIDOS SON ANFÓTEROS ? ¿A QUÉ SE DEBE ESTA CARACTERÍSTICA ?
Que un aminoácido es anfótero significa que en disolución acuosa , los aminoácidos son capaces de ionizarse y comportarse como ácido ,cediendo protones al medio ( cuando el medio es básico ), o como base captando protones del medio ( cuando el medio es ácido ) , permitiendo así regular el pH .
4.EN RELACIÓN A LA ESTRUCTURA DE LAS PROTEÍNAS
1.EXPLICA QUÉ ES LA ESTRUCTURA TERCIARIA Y QUÉ TIPO DE FUERZAS O INTERACCIONES PARTICIPAN EN EL MANTENIMIENTO DE LA ESTRUCTURA TERCIARIA . ¿ EXISTE UN NIVEL ESTRUCTURAL SUPERIOR A LA ESTRUCTURA TERCIARIA ? EN CASO AFIRMATIVO , INDICA EN QUÉ OCASIONES SE FORMA
La estructura terciaria es la disposición que toma en el espacio la estructura secundaria cuando se pliega sobre sí misma y origina una conformación globular . Los radicales apolares se sitúan hacia el interior y los radicales polares hacia el exterior , esto hace que las proteínaas globulares sean solubles en agua y en disoluciones salinas . Esta estructura, se mantiene estable gracias a las uniones entre los radicales de aminoácidos que están muy separados entre sí . Estas uniones pueden ser ; enlaces de hidrógeno , atracciones electroestáticas , fuerzas de Van der Waals , atracciones hidrofíbicas y puentes disulfuro .
Aquellas proteínas con estructura terciaria presentan tramos rectos con estructura secundaria del tipo α-hélice o lámina plegada , mientras que en las zonas de giro no tiene estructura secundaria .Las caracteresticas y funciones de las proteínaas dependen de este tipo de estructura .Según la estructura terciaria se pueden diferenciar dos tipos de proteínaas : globulares y fibrosas o filamentosas.
Por encima de la estructura terciaria , hay una estructura cuaternaria formada por proteínas constituidas por dos o más cadenas polipeptídicas con estructura terciaria , idénticas o no , unidas entre sí por enlaces débiles ( no covalentes ) y enlaces covalentes del tipo disulfuro . Cada una de estas cadenas polipeptídicas recibe el nombre de protómero y según cuantos se asocien se llaman dímeros , trímeros , tetrámeros …
B) AL MEDIR LA ACTIVIDAD DE LA ENZIMA HEXOQUINASA SE PRODUJO , ACCIDENTALMENTE , UN AUMENTO DE LA TEMPERATURA HASTA LOS 80 ºC. EN ESAS CONDICIONES NO SE DETECTÓ ACTIVIDAD DE LA ENZIMA . EXPLICA QUE PROCESO JUSTIFICA ESTA OBSERVACIÓN .
Lo que ocurre en este proceso es que la proteína se desnaturaliza por el aumento de temperatura, es decir que la proteína ha perdido su estado nativo debido a la rotura de los enlaces ya que al aumentar la temperatura , aumenta la energía cinética de las moléculas , con lo que se desorganiza la envoltura acuosa de las proteínas y la estructura y, por lo tanto, pierde su función .



